
نرم افزارهای طراحی پرایمر در دو نوع مختلف استفاده می شود. نوع اول تحت وب هستند و به صورت آنلاین می توان برای طراحی پرایمر از آنها استفاده کرد. از جمله این نرم افزارها می توان به primer 3، primer 3 plus، primer blast، PCR primer design و primerQuest اشاره کرد. یکی از معروف ترین نرم افزارهای تحت وب طراحی پرایمر ، نرم افزار primer 3 است و از این جهت قابل اعتماد است که الگوریتم آن دقیقا مثل ncbi است. محدودیت primer 3 این است که محدود به چند ژنوم خاص است ولی primer blast هر ژنومی را که بخواهیم می توانیم تعیین کنیم.
گروه دیگری از نرم افزارهای طراحی پرایمر هستند که قابلیت نصب روی کامپیوتر را دارند و نیاز به اینترنت ندارند.
از جمله این نرم افزارهای طراحی پرایمر می توان primer select، DNASIS Max، primer primer، OLIGO 7، Gene Runner و primer design را نام برد.
نرم افزار Oligo به عنوان یک ابزار ضروری و لازم برای طراحی و تجزیه و تحلیل پرایمر های PCR، ژنهای مصنوعی و انواع مختلف پروب ها (probe) از جمله siRNA و molecular beacons استفاده می شود. الگوریتم های جستجو در Oligo، بر مبنای جدیدترین اطلاعات، پرایمرهای بهینه شامل Taqman, highly multiplexed, consensus یا پرایمرهای degenerate را برای PCR پیدا می کند. در این نرم افزار طراحی پرایمر پردازش گروهی فایلها امکان پذیر بوده و علاوه بر این می توان از آن به عنوان ابزاری ارزشمند در تشخیص جهش های ژنتیکی استفاده نمود. Oligo تجزیه و تحلیلهای مختلف را به همراه اطلاعات مفیدی مانند DNA و ساختار ثانویه RNA، پرایمرهای نادرست، ترکیبات و خواص فیزیکی مفید و … را نشان می دهد.
در ادامه مقاله نرم افزارهای طراحی پرایمر به صورت مفصل نحوه کار با نرم افزار اولیگو (Oligo) ارایه می شود.
آموزش نرم افزار اولیگو 7
نرم افزار اولیگو 7 را می توان به عنوان یک ابزار ضروری و لازم برای طراحی و تجزیه و تحلیل پرایمرهای PCR، ژنهای مصنوعی و انواع مختلف پروب ها (probe) از جمله siRNA و molecular beacons نام برد. الگوریتم های جستجو درOligo 7، بر مبنای جدیدترین اطلاعات است و پرایمرهای بهینه شامل Taqman, highly multiplexed, consensus یا پرایمرهای degenerate را برای PCR پیدا می کند. در این نرم افزار پردازش گروهی فایل ها امکان پذیر بوده و علاوه بر این می توان از آن به عنوان ابزاری ارزشمند در تشخیص جهش های ژنتیکی استفاده نمود. هر پرایمر و یا جفت پرایمر، Oligo تجزیه و تحلیل های مختلف را به همراه اطلاعات مفیدی مانند DNA و ساختار ثانویه RNA، پرایمرهای نادرست، ترکیبات و خواص فیزیکی مفید و … را نشان می دهد.
از ویژگی های این نرم افزار می توان به طراحی پرایمرها به صورت خودکار، امکان طراحی پرایمر به صورت دستی، بررسی تشکیل ساختارهای ثانویه و سنجاق سری (hairpin) در پرایمرها، تجزیه و تحلیل پرایمرهای PCR، طراحی و تجزیه و تحلیل انواع پروب ها، نمایش ترکیب های مفید هر پرایمر می توان اشاره کرد.
پیدا کردن توالی ژن در طراحی پرایمر
برای طراحی پرایمر با هر نرم افزاری ابتدا باید از مبانی و اصول طراحی پرایمر را آگاهی کامل داشت. این اصول برای طراحی پرایمر با همه نرم افزارها یکسان است. برای طراحی پرایمری که کارایی بالایی داشته باشد، دانستن اینکه پارامترهای طراحی پرایمر به چه دلیل استفاده می شوند و محدوده تغییر آنها چقدر است، بسیار لازم و ضروری است که در مورد آنها در قسمت مبانی تئوری طراحی پرایمر مفصل توضیح داده شد. برا ی پیدا کردن توالی ژن مورد نظر ابتدا وارد سایت ncbi شوید. در این سایت دیتابیس های مختلفی را می توانید استفاده کنید. طبق شکل 1، در قسمت شماره 1، nucleotide را انتخاب کرده و در قسمت 2 نام ژن مورد نظر را بنویسید (شکل 1).
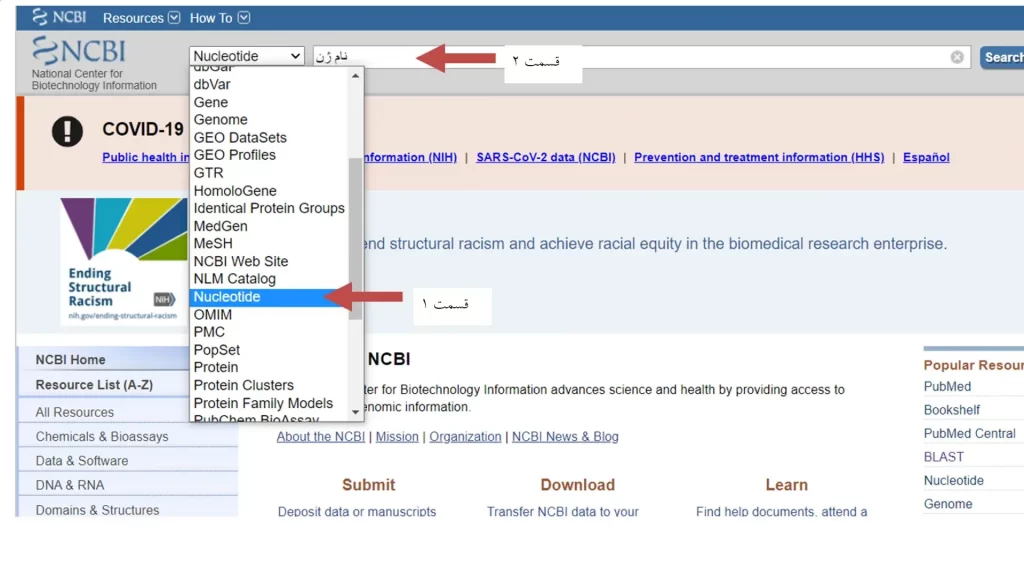
فرض کنید ما قصد داریم توالی آنتی ژن سطحی هپاتیت B را پیدا کنیم. در قسمت شماره 2 نام این ژن را نوشته و inter را کلیک می کنیم (شکل 2).
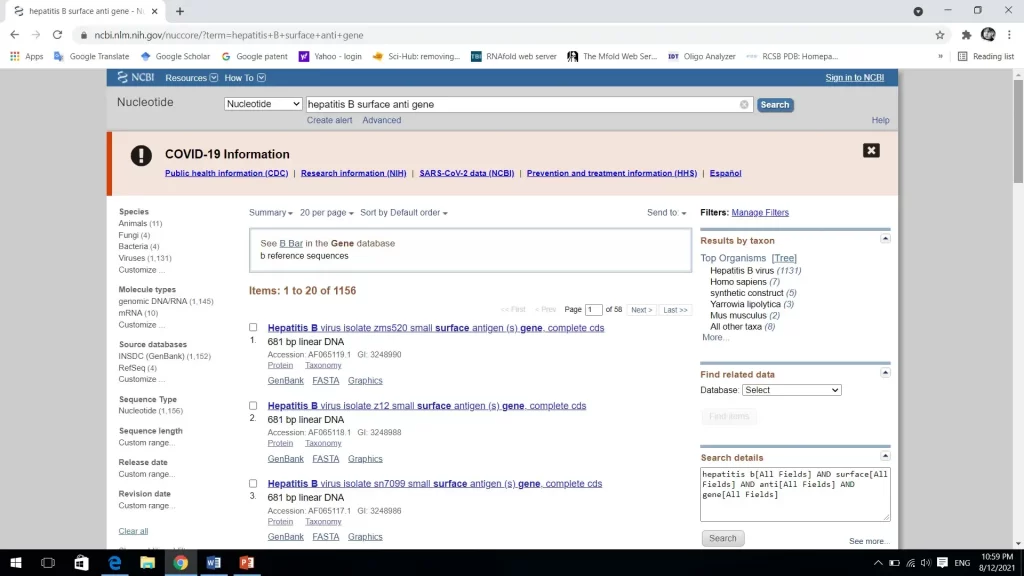
در جستجوی توالی ژنی، تعداد زیادی توالی توسط ncbi به شما معرفی می شود. همان طور که مشاهده می کنید نتیجه این جستجو 56 توالی است. اگر نمی دانید که توالی ژنی شما دقیقا کدام است، بهتر است برای پیدا کردن توالی ژنی از شماره دسترسی (accession number) که در مقالات وجود دارد استفاده کرد. توالی مورد نظر ما، اولین توالی با شماره دسترسی AF065119.1 است که آن را انتخاب می کنیم.
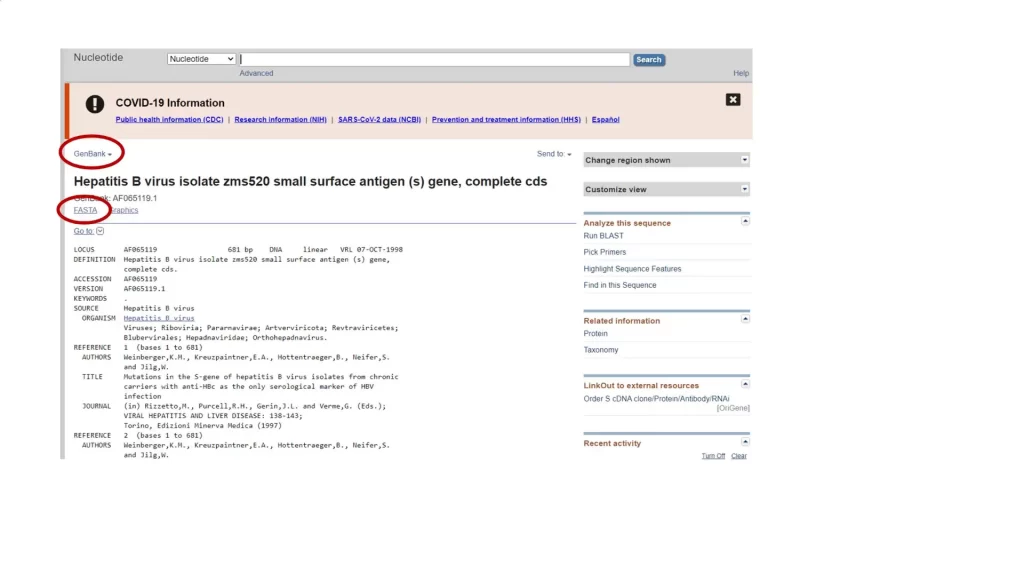
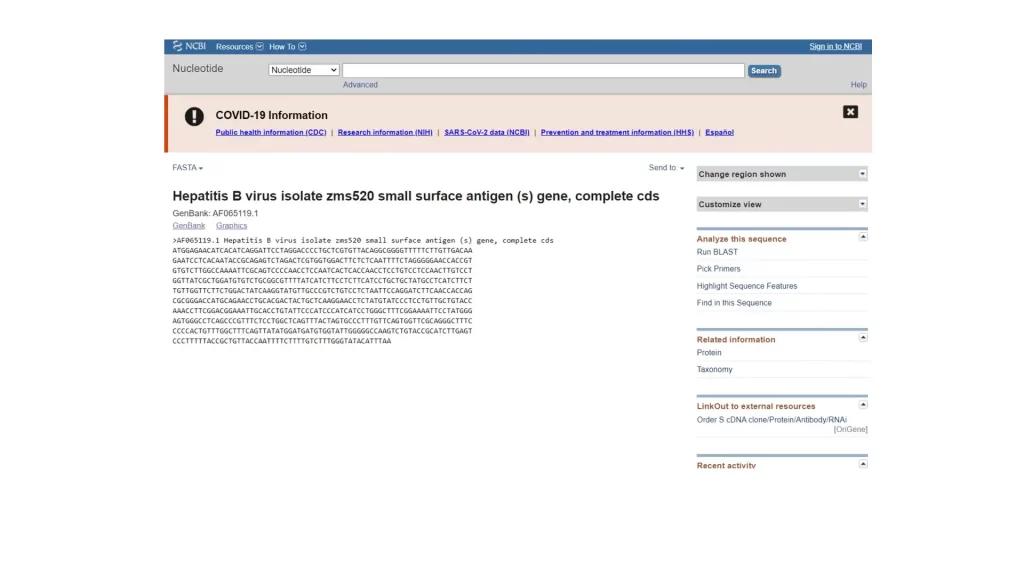
در قسمت GenBank علاوه بر توالی، همه اطلاعات مربوط به ژن را میتوانید ببینید (شکل 3). از این قسمت نمیتوان توالی ژن را کپی کرد. با انتخاب FASTA میتوان توالی را با فرمت FASTA دریافت کرد (شکل 4) از این قسمت میتوان توالی ژن را کپی کرد.
وارد کردن توالی جدید به نرم افزار Oligo 7 برای طراحی پرایمر
برای این کار ابتدا وارد نرم افزار شوید. از قسمت File، گزینه New Sequence را انتخاب کنید. با فشار دادن همزمان Ctrl N نیز می توانید از این منو استفاده کنید (شکل 5). همچنین میتوانید با استفاده از گزینه New Database و با داشتن شماره دسترسی و اتصال به اینترنت توالی مورد نظر را از دیتابیسهای ncbi، Add gene و … مستقیما به نرم افزار وارد کنید. گزینه Open، فایلهایی را که با فرمت FASTA روی کامپیوتر خود ذخیره کرده اید را برای شما باز میکند. گزینه Open recently، فایلهایی را که اخیرا توسط نرم افزار باز شده به شما نشان میدهد و این منو کار وارد کردن توالی را برای شما بسیار راحت میکند.
شکل 5. توالی را از ncbi کپی کنید و در پنجره باز شده paste کنید. سپس روی accept کلیک کنید (شکل 6). توالی وارد نرم
افزار میشود (شکل 7).
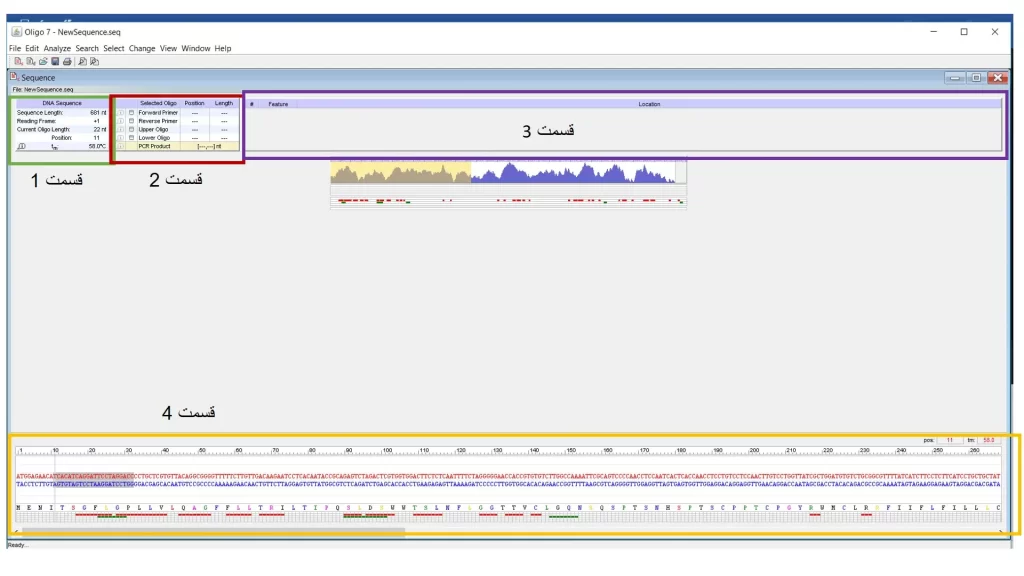
در قسمت بالا سمت چپ (قسمت شماره 1 که با کادر سبز رنگ در شکل 7 مشخص شده است) جدول مربوط به DNA sequence را مشاهده میکنید. این قسمت مشخصات کلی توالی را نشان میدهد. همانطور که در شکل 7 مشاهده میکنید طول قطعه تکثیری nt681 است. Open reading frame را هم 1 نشان داده است. Current oligo length هم طول توالی که با رنگ خاکستری در قسمت 4 مربوط به شکل 7 مشاهد میشود را نشان می دهد که nt 22 است. البته این طول قابل تغییر است که در ادامه اینکار انجام خواهد شد. و در انتها هم موقعیت توالی خاکستری را نشان می دهد. پوزیشنی که نشان میدهد اولین موقعیت از سمت چپ توالی خاکستری رنگ است. Tm این توالی را هم مشخص میکند.
پنجره دوم با کادر قرمز در شکل 7 نشان داده شده است. این پنجره selection نام دارد. هر توالی را که بخواهید به عنوان اولیگو یا پرایمر انتخاب کنید، اینجا انتخاب میشود و با کلیک روی دکمه forward و سبز رنگ شدن دکمه، آن توالی به عنوان پرایمر forward در نرم افزار انتخاب میشود.
وقتی پرایمرهای forward و reverse مشخص شد گزینه product برای شما فعال خواهد شد. اگر روی آیکونی که وسط آن i دارد کلیک کنید اطلاعاتی در مورد PCR و محصول آن به شما ارائه خواهد داد.
در پنجره سوم که در شکل 7 با کادر آبی نشان داده شده، میتوان بخشهای مختلفی از قطعه DNAایی که وارد نرم افزار شده است را مشخص کنید. به صورت default این نرم افزار کل قطعه را در نظر میگیرد. ولی شما در این بخش میتوانید یک قطعه مشخص را برای نرم افزار تعیین کنید که تنها از این بخش پرایمر طراحی شود. یا مثلا زمانیکه میخواهید نرم افزار برای شما پرایمر سرچ کند، میتوانید به نرم افزار دستور دهید که پرایمرها را از توالی nt 200- 500 طراحی کند.
در زیر این قسمت یک گراف دیده میشود که melting temperature graph نامیده میشود. این گراف به همراه خطهایی که زیر آن مشاهده میکنید zoon out area نامیده میشود. بخش پایین (قسمت 4) که با کادر نارنجی نشان داده شده zoom in area نامیده میشود. در قسمت zoon out area یک نمای کلی از توالی را در نرم افزار مشاهده میکنید. همانطور که در گراف دیده میشود در بعضی قسمتها Tm بالاتر و در بعضی قسمتها پایینتر است و این نمای کلی به شما کمک میکند که بهتر بتوانید از قسمتهای مختلف را برای طراحی پرایمر انتخاب کنید. قسمتی که در گراف زرد رنگ شده است را در قسمت zoom in area میتوانید مشاهده کنید.
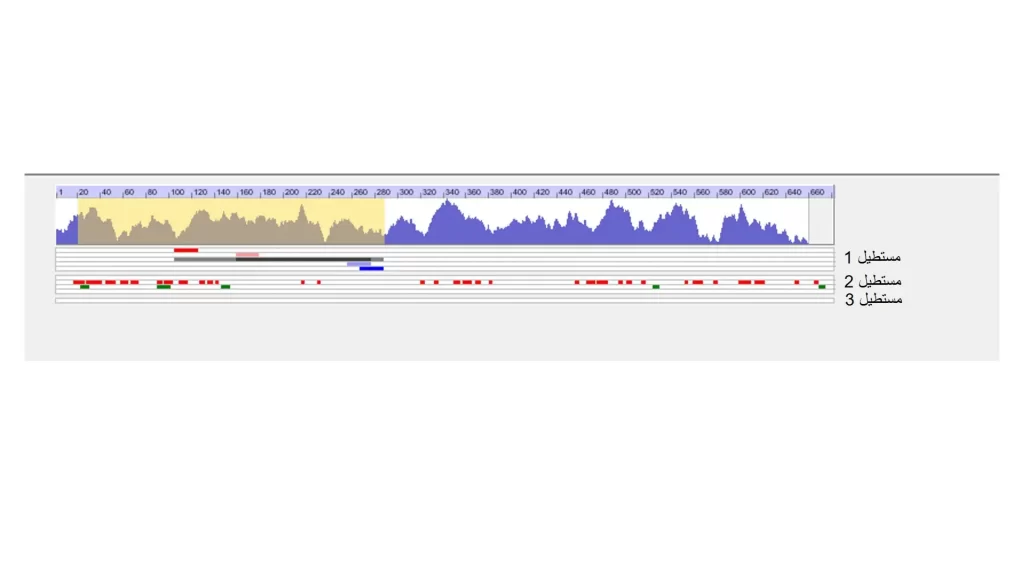
خطهای موازی که زیر zoon out area مشاهده میکنید (شکل 8) هر کدام بیانگر نکته مهمی هستند. مستطیل اول از 5 خط تشکیل شده است. خط اول محلی را که پرایمر forward از آن طراحی شده است را با رنگ آبی نشان میدهد. خط دوم محل طراحی upper oligo را نشان میدهدو خط سوم محصول PCR را با رنگ خاکستری نشان میدهد و خط چهارم بیانگر محل lower oligo است و خط پنجم هم نشانگر محل پرایمر reverse است که با رنگ آبی نمایش داده میشود.
مستطیل دوم دارای 4 خط است. خط اول نشان دهنده loopهای خیلی قوی است که با رنگ زرشکی نشان داده میشود و این نواحی برای طراحی پرایمر اصلا مناسب نیستند. خط دوم که تعداد زیادی بخش قرمز دارد loopهای ضعیف را نشان میدهد. میتوان از این قسمتها پرایمر طراحی کرد ولی حتما باید مشخصات پرایمر بررسی شود که این loopها در دمای بالا قابلیت تشکیل نداشته باشند و این قسمتها در حین PCR باز میشوند. خط سوم نواحی پالیندروم را نشان میدهد که با رنگ سبز دیده میشوند این نواحی هم برای طراحی مناسب نیستند. در خط چهارم اگر دنبال ناحیه خاصی روی توالی باشید نتیجه را به صورت کلی روی این خط نشان میدهد.
مستطیل سوم که تنها یک خط دارد هر بخشی از توالی را که در قسمت 3 انتخاب کردید برای شما نشان میدهد. تا زمانی که پرایمرها و الیگوها مشخص نشوند، این بخشها سفید رنگ خواهند بود.
نکته قابل ذکر این است که بعد طراحی پرایمر و سفارش سنتز آن، برای اینکه بهترین دمای تکثیر پرایمر تعیین شود باید از تکنیک Gradient PCR استفاده کرد.
تفاوت گرادینت PCR (گرادیان ترموسایکلر) و PCR معمولی چیست؟
مشخص کردن یک بخش خاص از توالی
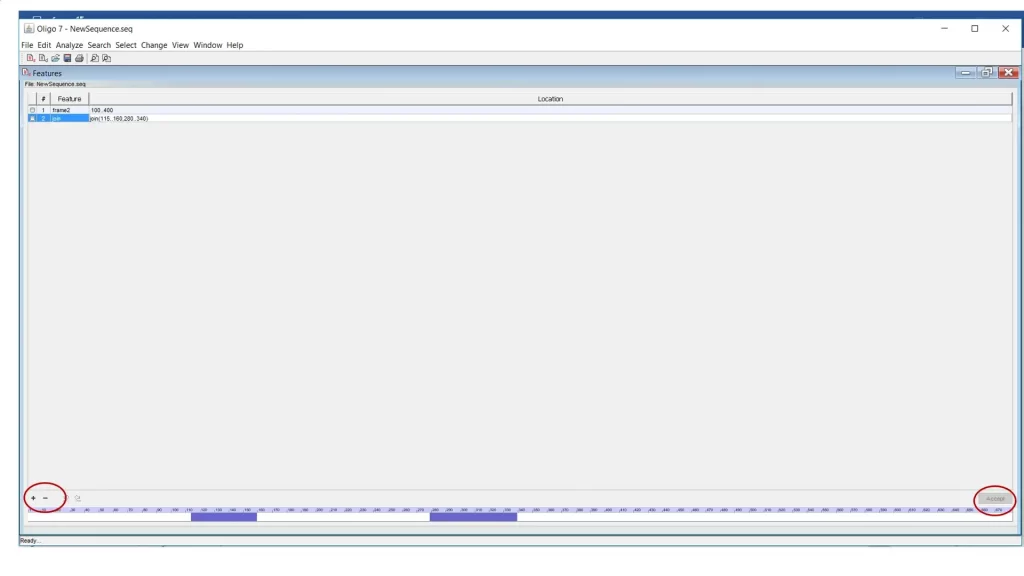
شما میتوانید یک قطعه مشخص را برای نرم افزار تعیین کنید و از نرم افزار بخواهید تنها از این بخش پرایمر طراحی شود. یا مثلا زمانیکه میخواهید نرم افزار برای شما پرایمر سرچ کند، میتوانید به نرم افزار دستور دهید که پرایمرها را از توالی nt 200- 500 طراحی کند. برای این کار ابتدا وارد منوی Edit شده و روی feature کلیک کنید. سپس روی + در پایین سمت چپ کلیک کنید تا یک بخش جدید برای شما ایجاد کند. سپس نام توالی را بنویسید و محدوده توالی را بصورت 100..400 تعیین کنید. اگر بخواهید روی یک بخش توالی دو قسمت مشخص کنید از دستور join استفاده کنید. این دستور Join(115..160,280..340) است. در نهایت روی accept کلیک کنید تا تغییرات اعمال شود (شکل 9). همانطور که در شکل مشاهده میکنید نرم افزار از نوکلیوتید 115 تا 160 و همچنین از 280 تا 340 توالی را با رنگ بنفش برای شما مشخص کرده است. اکنون میتوانید این پنجره را ببندید.
طراحی پرایمر به صورت دستی
فرض کنید میخواهیم پرایمری طراحی کنیم که طول آن nt 20 و mT آن حدود 52 یا 53 باشد. برای تعیین طول پرایمر وارد منوی Change شده و روی Current oligo length کلیک کنید و طول پرایمر را 20 انتخاب کرده و سپس Ok کنید. برای پیدا کردن پرایمری با Tm مورد نظر با استفاده از arrow key پرایمر را به چپ یا راست حرکت دهید و طبق انچه در شکل 10 مشاهده میکنید Tm را چک کنید.
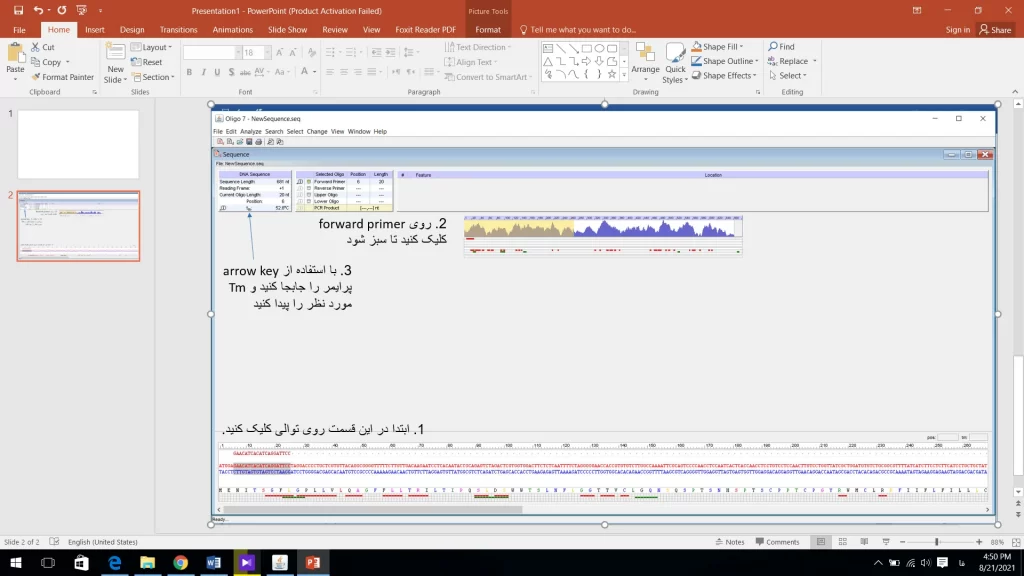
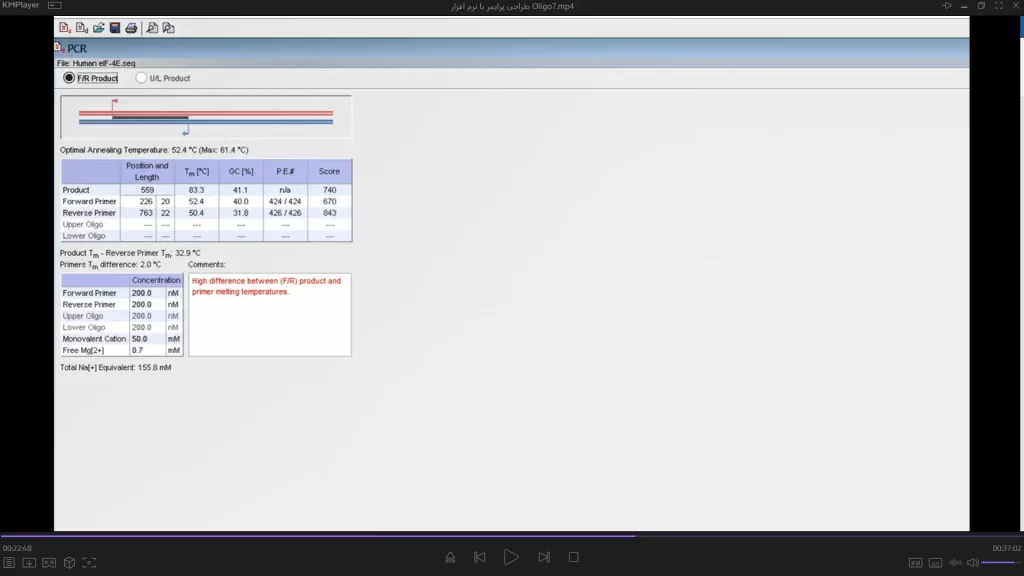
نکته مهم این است که بعد از هر بار تغییر مکان پرایمر باید روی forward primer کلیک شود تا mT پرایمر در مکان جدید نمایش داده شود. برای پرایمر reverse هم دقیقا همین مراحل انجام میشود. برای بررسی پرایمرهای انتخاب شده ابتدا وارد منو Analyze شده و گزینه PCR را انتخاب کنید (شکل 11). در این پنجره یک اطلاعات کلی در مورد PCR نشان داده میشود. اگر نکته ای وجود داشته باشد که شرایط مناسب برای انجام PCR نداشته باشد با رنگ قرمز اخطار میدهد. حتما به این هشدارها توجه شود و اشکالات پرایمر بر طرف شود. در اینجا مشکل پرایمر طراحی شده این است که اختلاف بین mTپرایمر و محصول زیاد است. این اختلاف دما نباید از 25 بیشتر باشد. بنابر این بهتر است از نقاطی که درصد GC بیشتری دارند پرایمر طراحی شود و یا اینکه طول پرایمر بیشتر شود (مثلا nt 22). جای پرایمر را تغییر دهید تا به پرایمر مطلوب برسید تا زمانیکه نرم افزار هیچ هشداری نداشته باشد.
1- بررسی Duplex primer
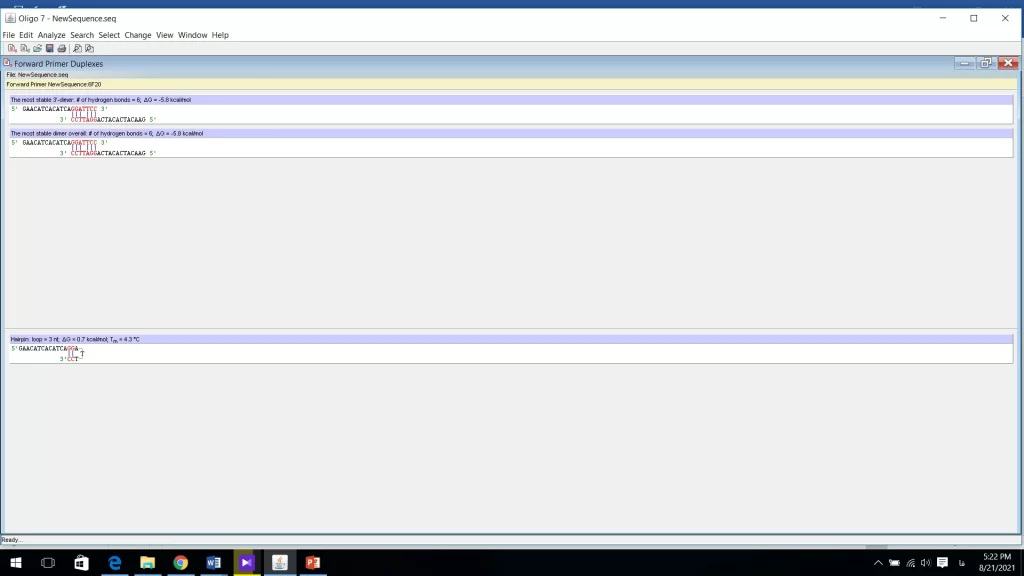
یک نکته بسیار مهم برای طراحی پرایمر بررسی این موضوع است که پرایمر forward و reverse مکمل هم نباشند و به اصطلاح duplex تشکیل ندهند (شکل 12). نتیجه این امر خارج شدن پرایمر از دسترس الگو است که به ضعیف شدن باند محصول در ژل الکتروفورز منجر میشود. در عوض، باندهای کوتاهی در پایین ژل الکتروفورز دیده میشوند که در نتیجه یک تکثیر اشتباهی ایجاد شدهاند. برای بررسی این موضوع مهم وارد منوی Analyze شده و سپس روی Duplex formation کلیک کرده و پرایمر forward را بررسی میکنیم. و سپس همین کار را برای پرایمر reverse انجام میدهیم. همانطور که در شکل 12 مشاهده میکنید پرایمر forward و reverse انتها های مکمل هم دارند که بسیار نامطلوب است و باعث در گیر شده آنزیم پلیمراز میشود و کارایی پرایمر پایین می آید. اطلاعاتی در این پنجره دیده میشود که باید به آنها توجه کرد، باندهای تشکیل شده است که تعداد این باندها نباید از 5 تا بیشتر شود. و نکته دیگر مقدار ΔGاست. هرچه ΔG منفی تر باشد ساختار پایدارتر است و باید از آن پرایمر صرف نظر کرد. ΔG بزرگتر از kcal/mol 5- عدد قابل قبول برای انواع دایمر است.
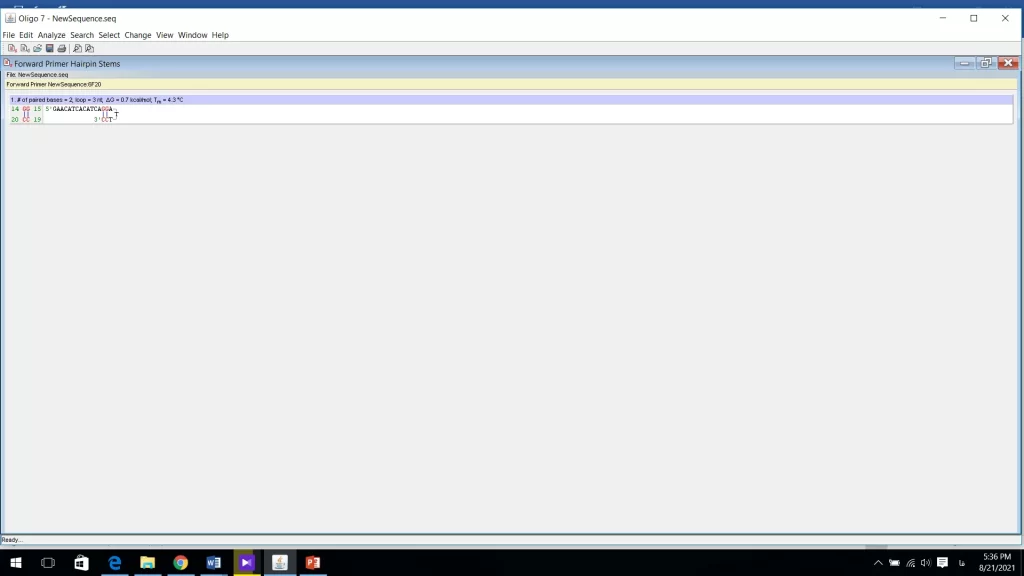
2- بررسی ساختار ثانویه (Hairpin formation)
پرایمرهای طراحی شده نباید hairpin تشکیل دهند. اگر یک پرایمر از انتهای ′3 یا ′5 روی خودش تا بخورد تشکیل hairpin میدهد. برای بررسی این موضوع وارد منوی Analyze شده و سپس روی Hairpin formation کلیک کرده و پرایمر forward را بررسی میکنیم. و سپس همین کار را برای پرایمر reverse انجام می دهیم (شکل 13). در اینجا نیز تعداد باندهای هیدروژنی تشکیل شده نباید از 5 تا بیشتر شود. و نکته دیگر مقدار ΔGاست. هرچه ΔG منفی تر باشد ساختار پایدارتر است و باید از آن پرایمر صرف نظر کرد. ΔG بزرگتر از kcal/mol 5- عدد قابل قبول برای انواع دایمر است. ساختاری که در شکل 13 مشاهده میشود در دمای 3/4 باز میشود. بنابراین این ساختار در PCR مشکلی ایجاد نخواهد کرد.
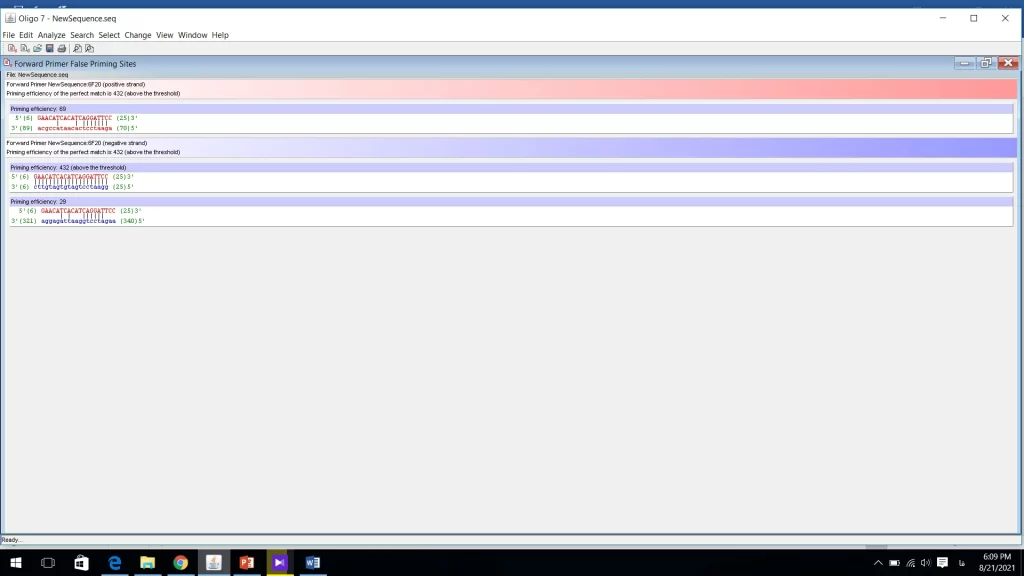
3- بررسی اختصاصی بودن پرایمرها
این نرم افزار این قابلیت را دارد که مکان هایی که پرایمر به صورت غیراختصاصی متصل می شود را بررسی کند. برای بررسی این موضوع وارد منوی Analyze شده و سپس روی False Priming Site کلیک کرده و پرایمر forward را بررسی میکنیم. سپس همین کار را برای پرایمر reverse انجام میدهیم (شکل 14). در شکل 14 پرایمر به سه مکان متصل می شود. ولی باید بررسی شود که این مکان ها خطرناک هستند یا خیر. پرایمری که همه نوکلئوتیدهای آن با رشته مقابل پیوند ایجاد کرده همان نقطه ایی است که ما پرایمر را برای آن طراحی کردیم و طبق آنچه در شکل مشاهده می کنید میزان priming efficiency برابر 432 است که این مقدار نسبت به بقیه حالت ها از همه بیشتر است و این امتیاز، ایده آل ترین حالت را نشان میدهد. این نرم افزار رشته sense را با رنگ آبی و رشته Antisense را با رنگ قرمز نشان میدهد. بر اساس تجربه اگر ایده آلترین مقدار (برای این پرایمر 432 است) تقسیم بر 5 شود، آنهایی خطرناک هستند که بیشتر از یک پنجم این مقدار ایده آل، امتیاز بدست آورند. پس اگر در طراحی خود پرایمرهایی با جایگاه اشتباه و امتیاز بالا داشتید باید آن پرایمر را اصلاح کنید.
اگر به این پارامتر دقت نشود ممکن است بعد از انجام PCR، روی ژل الکتروفورز آگارز باندهای غیر اختصاصی با اندازه متفاوت مشاهده شود.
بررسی کامل تکنیک الکتروفورز آگارز
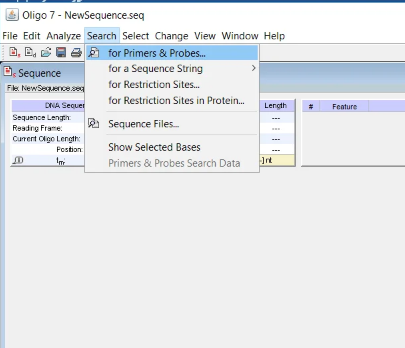
طراحی پرایمر به صورت اتوماتیک
م یخواهیم به نرم افزار دستور دهیم برای کل توالی پرایمر طراحی کند. برای این کار ابتدا وارد منوی search شده و سپس گزینه for primers probes انتخاب کنید (شکل 15).
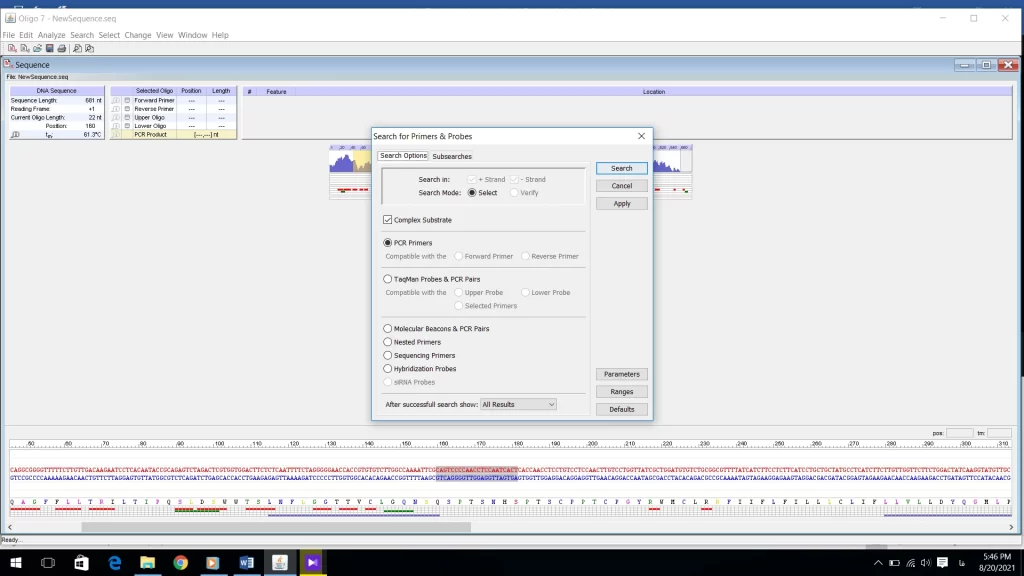
پنجره ایی باز میشود (شکل 16) که تنظیمات پرایمر را اینجا تعیین میشود. در قسمت search options تعیین میشود که پرایمر برای PCR طراحی شود. اگر بخواهید برای Real time PCR پرایمر طراحی کنید گزینه TaqMan Probes PCR Pairs را انتخاب کنید. در بخش سوم هم میتوانید با توجه به هدفی که دارید انواع PCR را انتخاب کنید. در قسمت Subsearch میتوانید مشخصاتی که پرایمر شما باید داشته باشه را به نرم افزار معرفی کنید. در مورد این مشخصات در فایل مبانی تئوری طراحی پرایمر به تفصیل ارائه گردید. معمولا تنظیمات بخش Subsearchرا تغییر نمی دهند زیرا در بهترین حالت بهینه به صورت default قرار گرفته است.
منوی انتخاب کنید و روی Parameters کلیک کنید. در اینجا میتوانید مشخصات PCR را تعیین کنید (شکل 17). چون نرم افزار برای تعیین دمای mTاز فرمول Nearest Neighbor استفاده میکند تغییر شرایط ازمایش میتواند در mTپرایمر تغییر ایجاد کند. بنابراین شرایطی را که در ازمایشگاه در آن PCR انجام میدهید را وارد کنید.
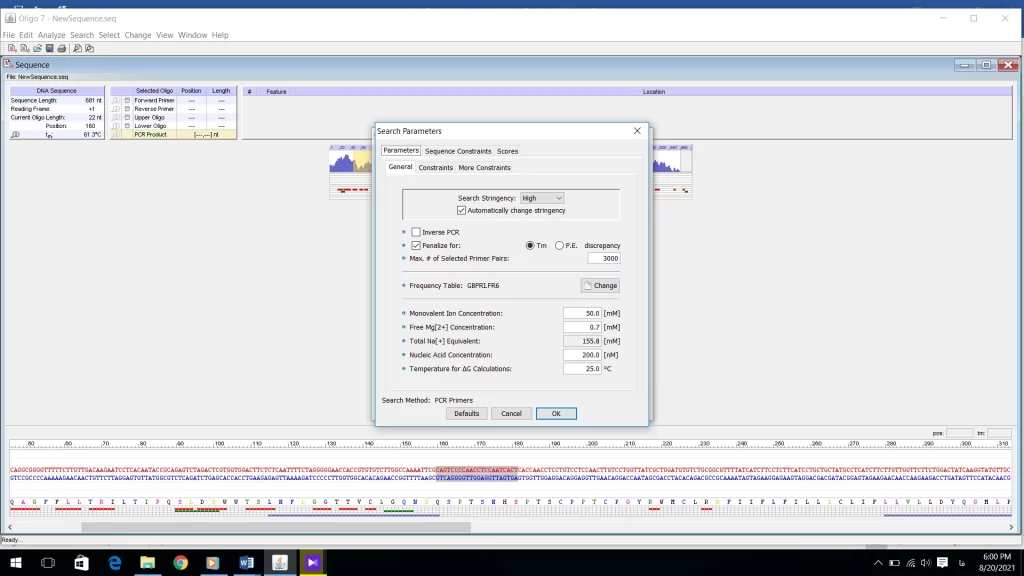
در منوی Constraints (شکل 18) میتوانید محدودیتها را برای پرایمر تعیین کنید. این محدودیتها مفصل در فایل مبانی تئوری طراحی پرایمر بحث شد. گزینه اول میتوانید طول پرایمر را تعیین کنید. و مقادیر بهینه را بر اساس شرایط آزمایش و آنچه قبلا در فایل مبانی تئوری طراحی پرایمر آورده شده انتخاب کنید.
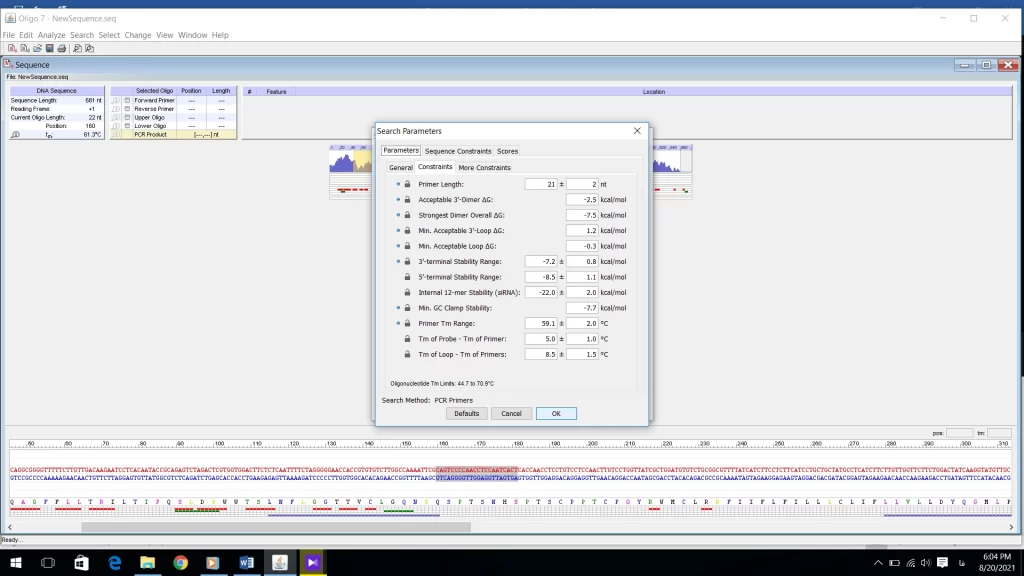
در منوی More constraints میتوانید مشخصات اختصاصیتری برای پرایمر خود به نرم افزار بدهید (شکل 19).
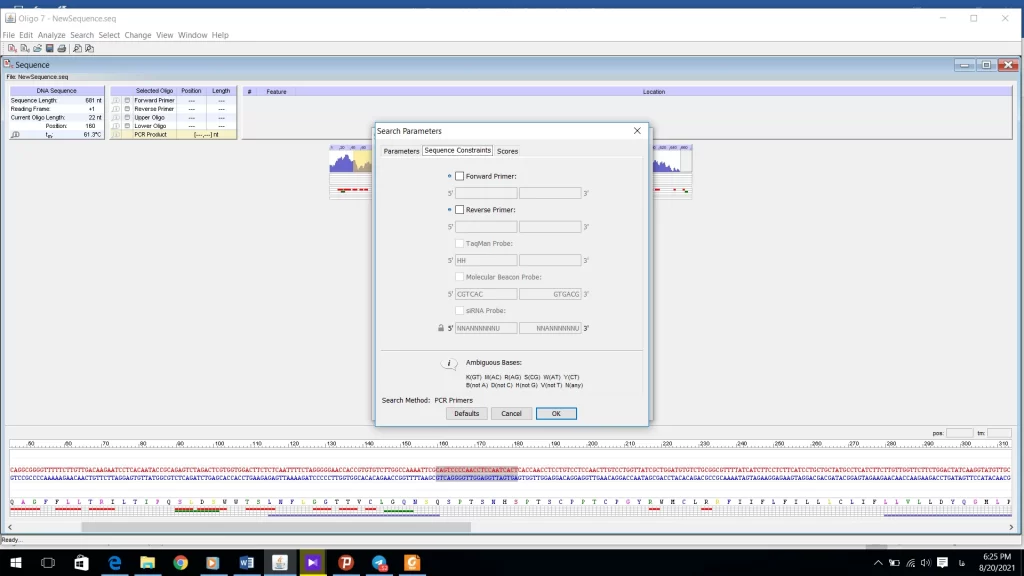
به منوی sequence Constraints (شکل 20) را تغییر ندهید. این منو برای کسانی است که می خواهند پرایمرشان توالی خاصی را دنبال کند. مثلا کسانی که کار کلونینگ انجام میدهند اگر بخواهند جایگاه برش آنزیمی روی پرایمرشان باشد از این منو استفاده میکنند.
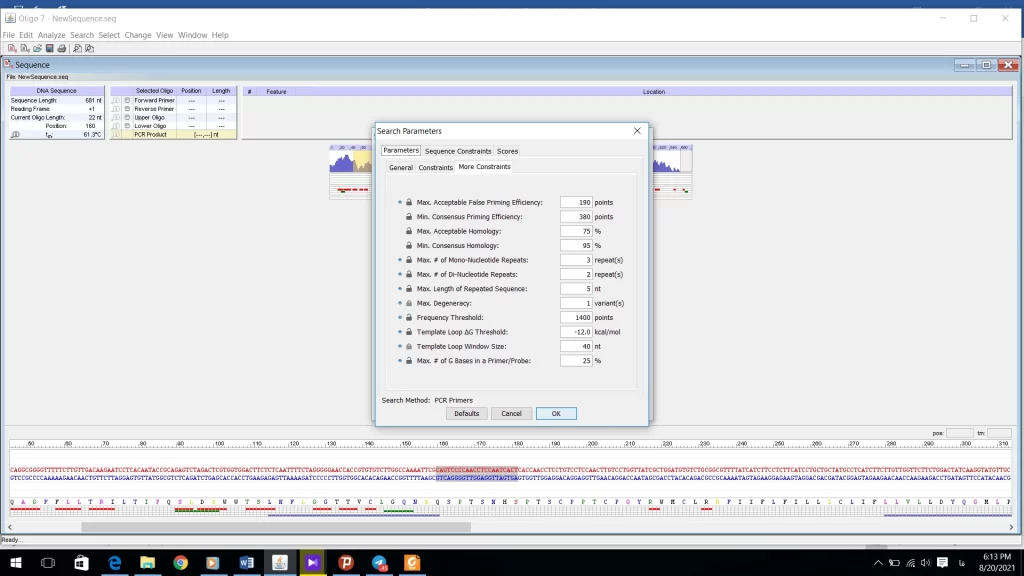
در قسمت Scores سیستم امتیاز دهی را نشان میدهد که نیازی به هیچ گونه تغییرات ندارد (شکل 21).
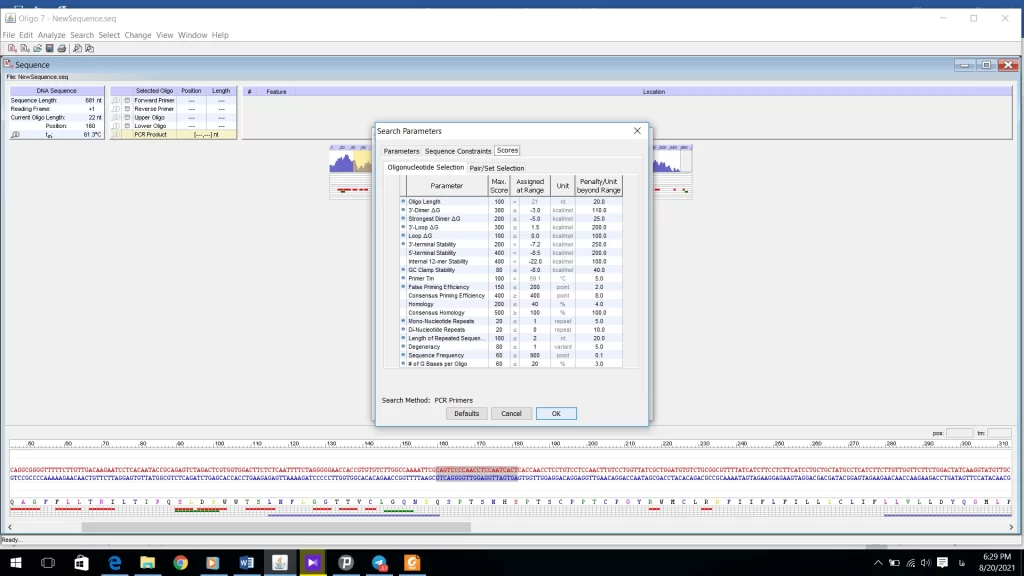
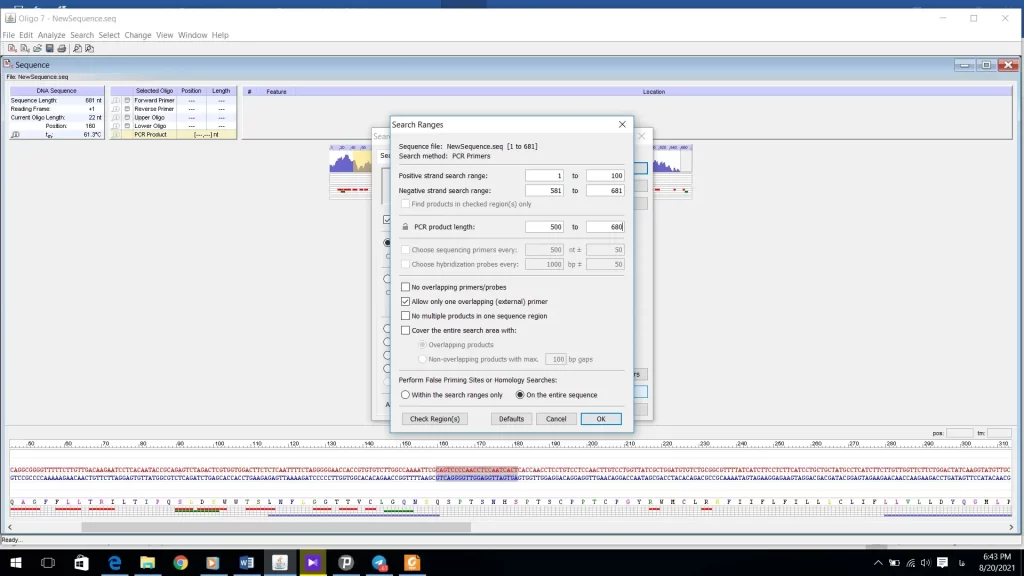
بعد از تنظیمات قسمت Parameters به قسمت Ranges در شکل 16 وارد شوید. در این قسمت محدودهایی که پرایمر forward روی رشته sense قرار میگیرد را تعیین میکنید و همچنین محدوده پرایمر reverse را که روی رشته منفی یا Anti-sense قرار دارد مشخص میشود. طول محصول PCR را هم میتوانید تعیین کنید (شکل 22). اگر تیک گزینهfind products in check region(s) only را فعال کنید دیگر نیازی به تعیین محدوده برای پرایمر نیست. بخشهای دیگر نیز نیاز به تغییر ندارند. Ok کنید و روی گزینه search کلیک کنید.
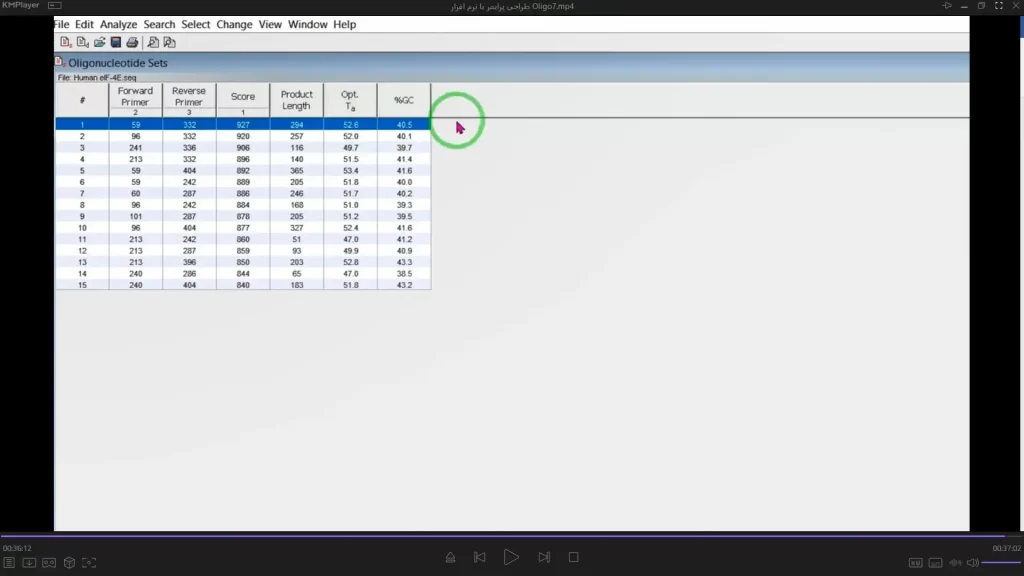
یک لیست از پرایمرهای پیشنهاد شده را برای شما تعیین میکند (شکل 23). که مشخصاتی مثل GC% و طول محصول و دمای Ta را برای شما مشخص میکند.
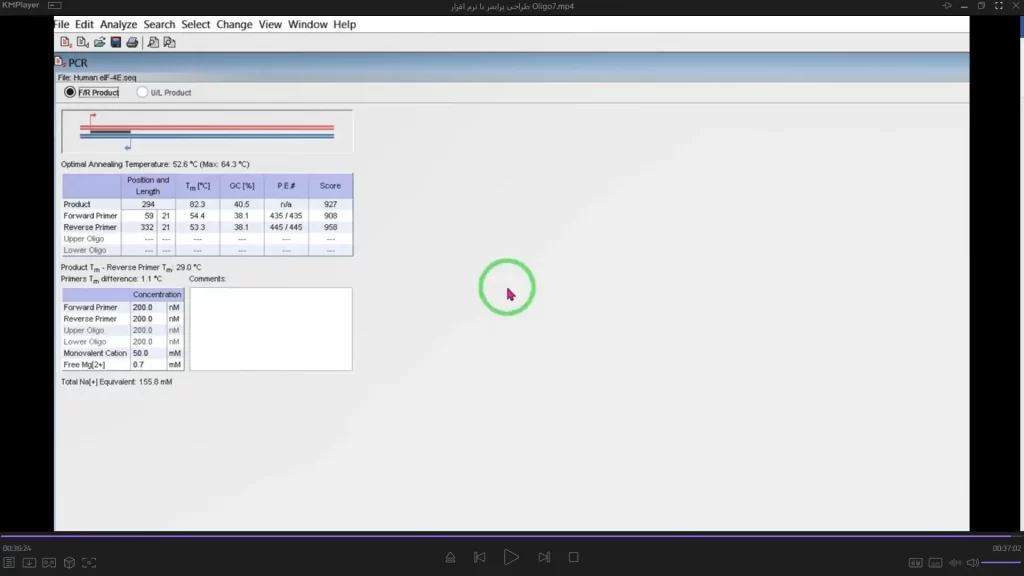
اگر روی هر کدام دو بار کلیک کنید مشخصات PCR را به شما نشان میدهد (شکل 24).
در این مقاله بصورت کامل کاربا نرم افزار oligo را بررسی کردیم





باسلام واحترام،یک سوال داشتم،پرایمرهایی که طراحی میشوند اولین بار،اگردر مقالات استفاده شده باش ایرادی داره؟